|
|
Material |
Referenzbereich |
Einheit |
Methode * |
| LPPLA2 |
Lipoprotein assoziierte Phospholipase A2 (LP-PLA2) |
|
| weiblich: |
|
< 507 |
| männlich: |
|
< 640 |
|
U/l |
|
| Synonyme |
PLAC ®, |
| Allgemeines |
Die Lipoprotein- assoziierte Phospholipase A2 (Lp-PLA2, auch Platelet activating factor acetylhydrolase, PAF-AH) ist ein Enzym, das von Makrophagen, Monocyten, T-Zellen und Mastzellen produziert wird. In der Zirkulation ist die Lp-PLA2 hauptsächlich an LDL-Cholesterin und zu einem geringeren Teil auch an HDL-Cholesterin gebunden. Sie stellt einen neuen Biomarker dar, der v.a. eine Aussage über die Stabilität der arteriosklerotischen Plaques zuläßt. Im Rahmen der Erfassung des kardiovaskulären Risikos liefert die Lp-PLA2 besonders im mittleren (moderaten) Risikobereich eine wertvolle Zusatzinformation für die Wahrscheinlichkeit des Auftretens eines Myokardinfarkts, Schlaganfalls und Mortalität. |
| Indikation |
Vor allem bei Patienten mit leicht bis deutlich erhöhtem kardiovaskulärem Risiko, bei Vorliegen zweier oder mehrerer Risikofaktoren. Nicht indiziert bei sehr geringem oder sehr hohem Risiko (instabile, progrediente koronare Herzkrankheit). |
| Präanalytik / Probenvorbereitung |
Blut nach Gerinnung innerhalb einer Stunde zentrifugieren und gekühlt, bei längerem Transport gefroren aufbewahren. |
| Bewertung |
Erhöht: Wahrscheinlichkeit für Myokardinfarkt, Schlaganfall und Mortalität erhöht bei Vorliegen zusätzlicher kardiovaskulärer Risikofaktoren (wie art. Hypertonie, Diabetes mellitus, Hyperlipoproteinämie, Rauchen, Übergewicht, erhöhtes CRP); eine strikte Kontrolle und Minimierung der kardiovaskulären Risikofaktoren wird empfohlen. |
| Schlüsselw. |
PLAC ®, |
|
|
|
|
Material |
Referenzbereich |
Einheit |
Methode * |
| LIPGEL |
Lipoprotein-Profil (sdLDL-Subklassen)
Serum nicht einfrieren! |
|
siehe Befund |
|
|
| Allgemeines |
Bisher ist auch heute das Problem der Risikoabschätzung für Gefäßerkrankungen noch nicht ganz gelöst. Konkurrierende Algorithmen, in denen die konventionellen Risikofaktoren wie Alter, Geschlecht, Rauchen, Lipide und Familienanamnese werden zur Errechnung eines globalen Herzinfarktrisikos herangezogen (z.B. SCORE, PROCAM und Framingham). Die wesentliche Schwäche dieser Vorhersagealgorithmen ist ihre geringe Sensitivität. Sie schwankt (bei akzeptabler Spezifität) um 30 Prozent. Das bedeutet, dass in der Gruppe derjenigen, die als Hochrisikopatienten identifiziert werden, nur etwa ein Drittel aller Herzinfarkte auftritt, während zwei Drittel aller Infarkte bei Personen mit niedrigerem rechnerischen Risiko vorkommen.
Um Personen ausfindig zu machen, die trotz eines vermeintlich mittleren oder niedrigen Risikos dennoch einen Herzinfarkt bekommen werden, sind daher oft ergänzende diagnostische Informationen wichtig. Zu nennen sind hier die sogenannten „neuen Risikofaktoren“ wie Homozystein, Vitamin D oder die Lipoprotein-assoziierte Phospholipase A2. Aber selbst die Untersuchung der Lipide ist mit der obligaten Basisdiagnostik (Cholesterin, Triglyzeride, LDL- und HDL-Cholesterin) nicht ausgereizt. Man weiß heute, dass die Lipoproteinklassen VLDL, LDL und HDL nicht homogen sind, sondern selbst wieder in eine Reihe von Unterfraktionen mit unterschiedlichen biologischen Funktionen aufgetrennt werden können.
Von besonderer Bedeutung sind die Unterfraktionen der LDL, für die ganz allgemein gilt: Je kleiner umso dichter, je größer umso „leichter“. Die „kleinen, dichten“ haben sich als sehr atherogen erwiesen (sd-LDL, small dense LDL). „Dichte“ LDL verweilen bis zu fünfmal länger im Plasma als „leichte“ und sind daher vermutlich anfälliger für Oxidation. Sie haften besser an den Proteoglykanen der Gefäßwand und penetrieren aufgrund ihres geringen Durchmessers leichter Lücken des Gefäßendothels. „Dichte“ LDL findet man häufig dann, wenn die Triglyzeride erhöht sind, also oft bei metabolischen Syndrom oder bei Typ 2 Diabetes mellitus. Diese Patienten haben meist auch ein niedriges HDL-Cholesterin. Die Kombination aus hohen Triglyzeriden, niedrigem HDL-Cholesterin und „dichten“ LDL bezeichnet man als „atherogene Trias“, als „atherogenen Lipoprotein-Phänotyp“. Obgleich zwischen den Komponenten der atherogenen Trias Korrelationen bestehen, lässt sich im Einzelfall das Verteilungsmuster der LDL-Unterfraktionen aus Triglyzeriden und HDL-Cholesterin nicht vorhersagen.
Die Lipoprotein-Gelektrophorese ist ein Verfahren, welches das tatsächliche Herzinfarktrisiko durch differenzierte Analyse der HDL- und LDL-Unterfraktionen ermittelt. |
| Indikation |
LDL-Subfraktionen:
- LDL-Cholesterin-Werte > 130 mg/dl und/oder Triglyzeride > 150 mg/dl und/oder HDL-Cholesterin < 40 mg/dl
- mittleres 10-Jahres Risiko nach PROCAM über 10 Prozent
- Risikopatienten mit Fettstoffwechselerkrankungen
- Patientenmonitoring unter Therapie (auch unter Cholesterinsenkern) |
| Präanalytik / Probenvorbereitung |
Serum oder alternativ EDTA-Plasma, haltbar bis 12 Stunden bei Raumtemperatur, gekühlt (2-8°C) bis 7 Tage. Transport und Lagerung gekühlt.
Material darf nicht eingefroren werden! |
| Bewertung |
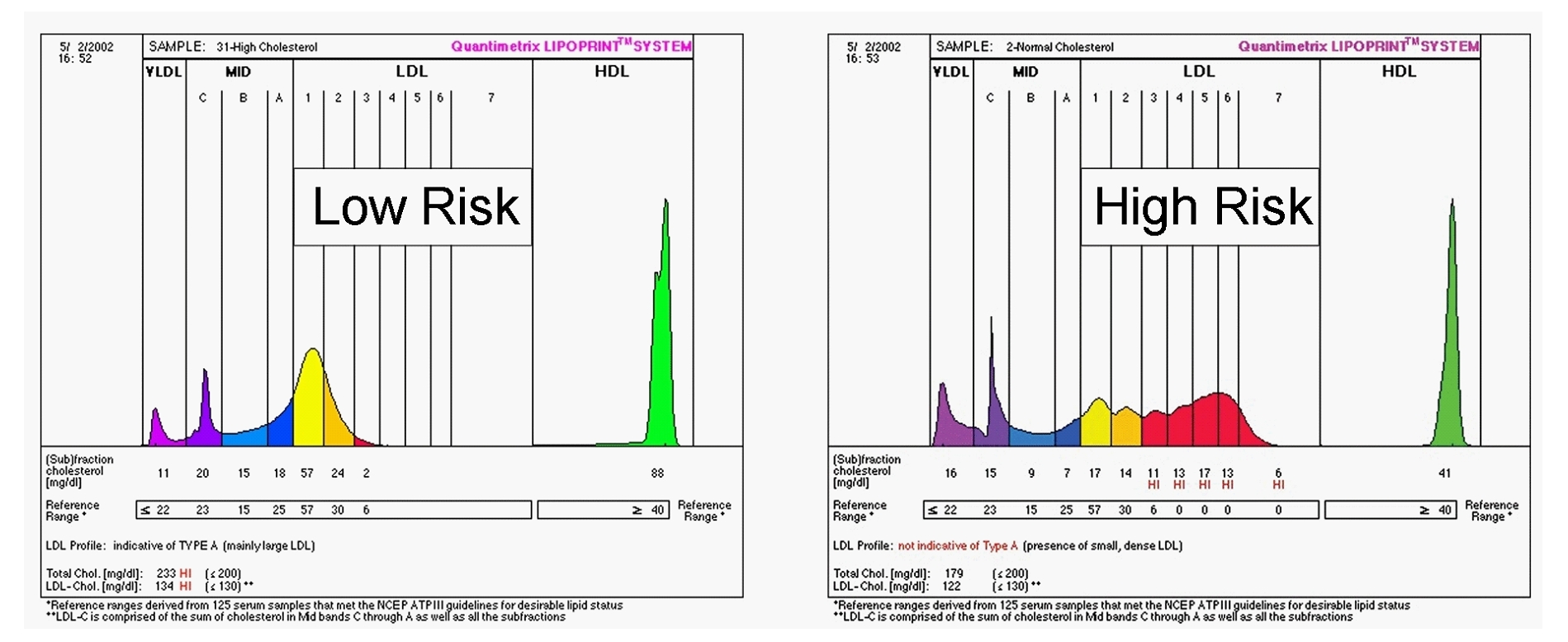
Im Lipoprotein-Profil werden bei den Ergebnissen ein Muster A von einem Muster B unterschieden. Beim Muster A liegt eine normalen Verteilung, beim dem Muster B ein Überwiegen der kleinen, dichten LDL vor.
Statine senken alle LDL-Subfraktionen in etwa gleichem Maß, Fibrate, Nikotinsäure und Pioglitazon senken eher die kleinen, dichten LDL. Die Effekte von Ezetimibe auf die Verteilung von LDL-Subfraktionen werden noch kontrovers diskutiert. In einzelnen Arbeiten wurde vor allem eine Absenkung der leichten, weniger atherogenen LDL beobachtet. |
| Schlüsselw. |
LDL-Subfraktionen, LDL-Unterfraktionen, Lipidprofil, Lipoprint |
|
|
| Lysosomale Diagnostik |
|
|
Material |
Referenzbereich : |
Einheit |
Methode * |
| AFUC |
alpha-Fucosidase >> Anhang
Fucosidosis |
|
|
nmol/spot |
|
| AGALE |
alpha-Galaktosidase im Leuko
Morbus Fabry
nicht akkreditiert |
|
siehe Befund |
nmol/min/mg prot |
|
| AGAL |
alpha-Galaktosidase >> Anhang
Morbus Fabry |
|
|
nmol/h/mL |
|
| AGLU1 |
alpha-Glucosidase 1 >> Anhang
Morbus Pompe |
|
|
nmol/spot |
|
| AIDU |
alpha-Iduronidase >> Anhang
Morbus Hurler, MPS I |
|
|
pmol/spot |
|
| AMANN |
alpha-Mannosidase >> Anhang
Mannosidose |
|
siehe Befund |
nmol/spot |
|
| ARSUAE |
Arylsulfatase A im Leukozyten (ARSA) >> Anhang
Metachromatische Leukodystrophie (MLD) |
|
|
mmol/h/mg Protein |
|
| ARSUA |
Arylsulfatase A im Serum (ARSA) >> Anhang
Metachromatische Leukodystrophie (MLD) |
|
|
nmol/h/mL |
|
| ARSUAU |
Arylsulfatase A im Urin (ARSA) >> Anhang
Metachromatische Leukodystrophie (MLD) |
|
|
nmol/h/mL |
|
| ARSUB |
Arylsulfatase B >> Anhang
Morbus Lamy-Maroteaux, MPS VI |
|
|
pmol/punch*20h |
|
| BGALCB |
beta-Galaktocerebrosidase >> Anhang
Morbus Krabbe |
|
|
pmol/spot |
|
| BGALN |
beta-Galaktosidase >> Anhang
beta-Galaktosidase wird zusätzlich auch als Referenzenzym bestimmt.
GM1, Morquio |
|
|
nmol/spot*21h |
|
| BGLUCN |
beta-Glucosidase >> Anhang
Synonym Glucocerebrosidase
Morbus Gaucher |
|
|
pmol/spot*20h |
|
| BGLUR |
beta-Glucuronidase >> Anhang
Sly-Syndrom, MPS VII Hydrops fetalis |
|
|
nmol/spot |
|
| CHIT |
Chitotrionidase im Serum >> Anhang
zusätzlich Referenzenzym gesamt-Hexosaminidase zur Bestimmung der Chitotriosidase notwendig,
Morbus Gaucher |
|
|
|
|
| CHITO |
Chitotriosidase, Messwert |
|
|
nmol/ml/h |
|
| CHITOP |
Chitotriosidase, Prozent der Norm, Rechenwert |
|
|
% |
|
| HEAB2 |
Hexosaminidase A&B |
|
|
mU/ml |
|
| HEAB2P |
Prozent der Norm - HEXAB2 |
|
|
% |
|
| CHITON |
Chitotriosidase neonatal >> Anhang
Morbus Gaucher |
|
|
pmol/Stanze/h |
|
| HEXA |
Hexosaminidase A >> Anhang
Bestimmung nur zusammen mit Hexosaminidase AB (gesamt) möglich.
Morbus Tay-Sachs |
|
|
nmol/spot*21h |
|
| HEXAB |
Hexosaminidase A, B >> Anhang
Morbus Bernheim-Seitelberger |
|
|
nmol/spot*21h |
|
| IDU2S |
Iduronat-2-Sulfatase >> Anhang
Morbus Hunter, MPS I |
|
|
nmol/spot |
|
| MPSEL |
Mucopolysaccharid-Diagnostik im Urin >> Anhang |
|
|
|
|
| GAG |
Mucopolysaccharid-Suchtest im Urin (MPS) >> Anhang
Einzelanforderung möglich |
|
siehe Befund |
mg/mmol Krea |
|
| MPSU |
Mucopolysaccharid-Schnelltest im Urin >> Anhang
Vortest für MPS-Elektrophorese, nur im Zusammenhang mit MPS-Suchtest und MPS-Elektrophorese möglich |
|
siehe Befund |
mg/mmol Krea |
|
| MPSELU |
Mucopolysaccharid-Elektrophorese im Urin (MPS)
nur im Zusammenhang mit MPS-Schnelltest und MPS-Suchtest möglich |
|
siehe Befund |
|
|
| GAG |
Mucopolysaccharid-Suchtest im Urin (MPS) >> Anhang
Einzelanforderung möglich |
|
siehe Befund |
mg/mmol Krea |
|
| NAGU |
N-Acetyl-Glucosaminidase (U) pro g Krea (NAG) >> Anhang
V.a. Sanfilippo-Syndrom, MPS III |
|
|
|
|
| NAG |
N-Acetyl-Glucosaminidase (U), Messwert |
|
siehe Befund |
U/l |
|
| NAGK |
N-Acetyl-Glucosaminidase (U) pro g Krea, Rechenwert >> Anhang |
|
|
U/g Krea |
|
| OSACU |
Oligosaccharide im Urin >> Anhang |
| Urin |
10 ml |
oder
|
| Urin, gefroren |
10 ml |
|
siehe Befund |
|
|
| PPT |
Palmitoyl-Protein-Thiosterase >> Anhang
CLN1, Lipofuszinose, NCL |
|
|
nmol/spot |
|
| PIPS |
Pipecolinsäure >> Anhang
Morbus Refsum, Zellweger |
| EDTA-Plasma, gefroren |
0,5 ml |
|
|
μmol/l |
|
| SPMYE |
Sphingomyelinase >> Anhang
Morbus Niemann-Pick |
|
|
pmol/spot |
|
| TRPP |
Tripeptidyl-Peptidase >> Anhang
CLN1, Lipofuszinose, NCL |
|
|
nmol/spot |
|
|

